SEVem: Verificació de medicaments a l’oficina de farmàcia
A partir del 9 de Febrer de 2019 la farmàcia haurà d’autentificar el medicament en el moment de la dispensació
El 2011, es va publicar la Directiva 2011/62/UE del Parlament europeu i del Consell de 8 de juny de 2011 que modifica la Directiva 2001/83/CE per la que s’estableix un codi comunitari sobre medicaments d’ús humà, en el relatiu a la prevenció de l’entrada de medicaments falsificats a la cadena de subministrament legal (en endavant, la Directiva). L’objectiu d’aquesta normativa és impedir que els medicaments falsificats entrin a la cadena de subministrament.
El febrer de 2026, la Comissió Europea va publicar un desenvolupament normatiu de la Directiva, el Reglament Delegat (UE) 2016/161 -en endavant, el Reglament Delegat- que concreta les obligacions dels fabricants, majoristes i farmacèutics en el moment de garantir que els medicaments subministrats als pacients siguin autèntics.
A Espanya, SEVeM S.L és l’entitat jurídica sense ànim de lucre establerta d’acord amb l’exigit per l’article 54 bis de la Directiva 2001/83/CE del Parlament Europeu i el Consell, i desenvolupat pel Reglament Delegat (UE) 2016/161 de la Comissió Europea.
Les organitzacions socis fundadors de SEVeM són: l’Associació Nacional Empresarial de la Indústria Farmacèutica (FARMAINDUSTRIA), l’Associació Espanyola de Medicaments Genèrics (AESEG), la Federació de Distribuïdors Farmacèutics (FEDIFAR) i el Consell General de Col•legis Oficials de Farmacèutics (CGCOF).
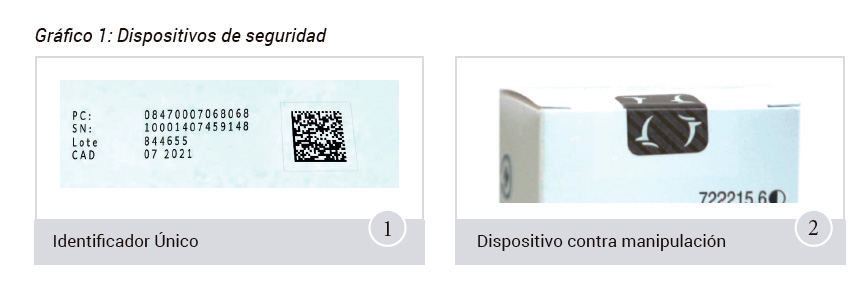
A resultats d’aquesta normativa, tots els fabricants i titulars de l’autorització de comercialització (TACs), ja siguin laboratoris d’innovació, genèrics o importadors paral•lels, hauran d’incorporar dos tipus de dispositius de seguretat en tots els envasos de medicaments subjectes a l’obligació de ser verificats.
- El primer dispositiu és un codi bidimensional en format Datamatrix que identifica individualment l’envàs.
- El segon és un dispositiu contra manipulació, que permetrà verificar si l’embalatge exterior ha patit cap mena de manipulació. Veure el gràfic 1.
Addicionalment, l’Agència Espanyola de Medicaments i Productes Sanitaris participa en les reunions del Consell d’Administració, per a fins de supervisió de l’establiment i gestió del sistema, d’acord amb el previst al Reglament Delegat. A les reunions de les comissions tècniques assisteixen representants del Ministeri de Sanitat, Consum i Benestar Social, així com representants de la Comissió Permanent de Farmàcia del Consell Inter territorial del Sistema Nacional de Salut (CISNS).
Els fabricants i titulars de l’autorització de comercialització introduiran aquests identificadors únics per a tots els envasos subjectes a l’obligació de verificació, que s’hagin de comercialitzar a la Unió Europea i a l’Espai Econòmic Europeu, en una base de dades central, també anomenada “Plataforma Europea”.
Aquesta plataforma connectarà amb els sistemes nacionals, assegurant la inter operabilitat entre ells. Els codis dels medicaments serialitzats es descarregaran al mercat de destí, per exemple, a Espanya es transferiran a SEVeM, el Sistema Español de Verificació de Medicaments.
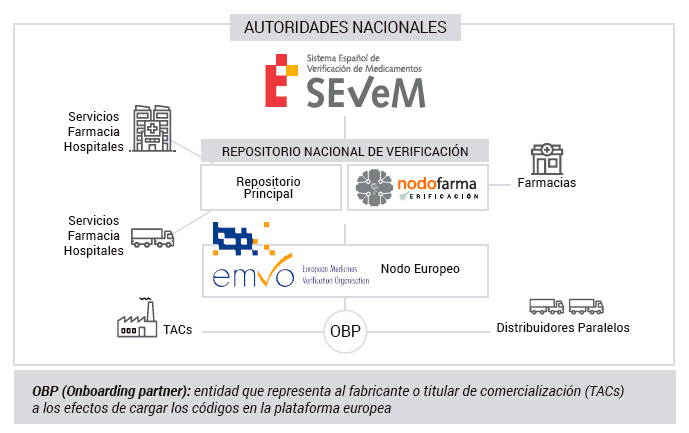
En el seu circuit, a través de la cadena del medicament, l’envàs serà verificat i/o autenticat. Els distribuïdors només verificaran en els casos previstos en la normativa europea i nacional, en base a anàlisi de risc.

Descarrega la informació complerta en la documentació clicant aquí.